Quand la biologie rencontre l’électronique – Roisin Owens, Mines Saint-Etienne
Depuis son arrivée à Mines Saint-Etienne en 2009, la chercheuse Róisín Owens crée de curieux dispositifs : des cultures cellulaires couplées à du matériel électronique, capable de mesurer en temps réel l’état de santé et les réactions des cellules face à un médicament ou un pathogène. Les résultats particulièrement prometteurs de ce nouveau domaine, la bioélectronique, pourraient bien changer le visage de la toxicologie de demain.
Télécharger l’article en format PDF
En sciences, les découvertes sont parfois affaires de rencontres. C’est sûrement celle de Róisín Owens et de son mari, George Malliaras, qui les a conduits vers ce nouveau champ de recherche, la bioélectronique. « J’étais biologiste, spécialisée dans les maladies infectieuses, et lui était expert en physique et sciences des matériaux » raconte Róisín Owens. « Il me parlait de ces nouvelles technologies, et je me disais qu’elles pouvaient être appliquées à la biologie. Nous avons donc imaginé ensemble ce projet de département réunissant biologie et électronique côte à côte ». Ce projet se concrétisera en 2009 au Centre Microélectronique de Provence de Mines Saint-Étienne, situé à Gardanne, avec la création du département de Bioélectronique. Alors qu’une partie du département se penche sur les neurosciences, avec l’équipe de George Malliaras, ou, plus récemment, sur l’électronique sur textile, au travers des recherches menées par Esma Ismailova, Róisín Owens monte le programme IONOSENSE (cf. encadré), visant à créer un nouveau dispositif de diagnostic in vitro.
L’électronique organique au cœur du système
À la base des recherches menées par Róisín Owens et son équipe, il y a l’électronique organique. Contrairement à l’électronique traditionnelle, basée sur des matériaux rigides comme le silicium ou le cuivre, l’électronique organique utilise des polymères flexibles qui offrent une meilleure interface avec la biologie. « De plus, ces matériaux sont transparents, ce qui permet d’observer directement les cellules dans le dispositif » note la chercheuse irlandaise. À Gardanne, ces structures de polymères constituent des dispositifs appelés « transistors organiques », qui relèvent avec une grande sensibilité la conductivité. « Les cellules entre les électrodes du polymère et celles du transistor agissent comme une résistance en limitant le transfert d’ion, ce qui est mesurable » explique-t-elle. « Si les cellules sont malades, touchées par une toxine par exemple, elles offrent une résistance plus faible. Nous pouvons donc mesurer l’état de santé d’une culture cellulaire en temps réel ».
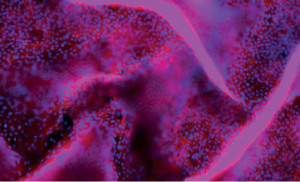 Visualisation du détachement d’une couche de cellules épithéliales du rein dans un modèle 3D par fluorescence
Visualisation du détachement d’une couche de cellules épithéliales du rein dans un modèle 3D par fluorescence
Des cultures cellulaires en trois dimensions
Pendant de longs mois, il a fallu prouver la validité des résultats sortis de ces petits dispositifs. La transparence des polymères a alors été d’une aide précieuse, permettant de confronter les mesures électroniques aux observations directes. Puis, Róisín Owens et son équipe ont voulu aller plus loin en explorant les possibilités de ce nouveau système dans d’autres domaines, notamment en étudiant non plus des cellules entières mais seulement des bicouches lipidiques avec protéines intégrées, permettant d’observer des interactions entre la paroi cellulaire et des pathogènes. Mais surtout, la biologiste a délaissé les lames de verre pour se tourner vers des structures en trois dimensions. « En toxicologie, nous savons qu’il y a une grande différence entre des cellules in vivo et des cultures sur des substrats bidimensionnels ». L’équipe façonne alors les polymères conducteurs pour créer de véritables échafaudages en trois dimensions sur lesquels seront ensemencées les cellules, dont les propriétés peuvent toujours être étudiées en temps réel.
Mimer le vivant in vitro
Un modèle de rein in vitro est ainsi créé, intégrant de plus la microfluidique à l’échafaudage. « Dans le rein, il y a du sang, de l’urine, et entre les deux des cellules épithéliales et endothéliales » décrit Róisín Owens. « Pour avoir un modèle cellulaire réaliste sur la toxicologie du rein, il faut tous ces éléments ». Au final, l’équipe produit un dispositif comprenant 12 puits, chacun constitué d’un transistor, d’un système représentant l’urine, d’une membrane comportant des cellules épithéliales d’un côté, endothéliales de l’autre et enfin d’un autre tube pour le sang. « Nous avons toujours de la transparence pour que les biologistes puissent observer les cellules, de l’électronique pour mesurer leur conductivité, mais aussi de la microfluidique, ce qui permet de mesurer la présence de biomarqueurs sécrétés par les cellules dans les tubes » résume la biologiste.
De l’invention à la commercialisation
Si ces résultats sont particulièrement prometteurs, la route reste cependant encore longue avant que ces dispositifs ne soient utilisés dans les laboratoires. « Nous voudrions améliorer notre technique dans l’optique d’une fabrication commerciale, mais il nous faut d’abord faire davantage de validations pour convaincre de l’efficacité de notre système » reprend Róisín Owens. « En dehors de la toxicologie, il y a aussi l’aspect recherche fondamentale : l’utilisation simultanée de l’optique et de l’électronique pourrait permettre de mieux comprendre des mécanismes d’adhésion et de mouvements des cellules, ce qui intéresse notamment les cancérologues ». Du côté de l’industrie pharmaceutique également, ce nouveau procédé développé au Centre Microélectronique de Provence a des atouts à faire valoir. « Sortir un nouveau médicament peut coûter plus d’un milliard d’euros pour douze ans de développement, pourtant, 90 % de ces médicaments n’ont pas l’effet voulu sur l’être humain » souligne la chercheuse. « Ceci est notamment dû au fait que ces essais sont effectués sur des animaux, très différents de l’Homme : il faut donc améliorer les études in vitro sur des cellules humaines, avec des modèles plus prédictifs qui limitent le nombre de faux positifs ». Selon Róisín Owens, il faudra encore compter une petite dizaine d’années avant que son système ne se démocratise dans les laboratoires. En attendant, elle réfléchit déjà à créer une société visant à développer des assemblages spécifiques pour un besoin particulier, à la demande. L’histoire de la bioélectronique ne fait donc que commencer.
IONOSENSE : un programme doublement primé
Les travaux menés par Róisín Owens à Mines Saint-Etienne sont intimement liés à un projet : IONOSENSE, pour Exploitation of Organic Electrochemical Transistors for Biological Ionsensing. Lancé en 2011 grâce à une bourse Starting grant de l’European Research Council (ERC) d’un montant de 1,5 million d’euros, ce programme a permis le développement des premiers dispositifs bioélectroniques. « Nous avons montré que nous pouvions grâce à ces dispositifs détecter la présence de différents pathogènes : un virus, une toxine et une bactérie » détaille Róisín Owens. En parallèle d’autres axes de recherche (microfluidique, biofilms, etc.), le programme IONOSENSE suit alors son cours jusqu’à son échéance annoncée en 2015. Mais c’était sans compter une nouvelle bourse prestigieuse de l’ERC obtenue fin 2014: une Proof of concept de 150 000 euros pour une année supplémentaire, année qui sera employée à travailler sur la commercialisation possible de cette technique. Pour Róisín Owens, ces récompenses sont bien entendu un formidable soutien financier, mais pas seulement. « D’un point de vue personnel, c’est particulièrement gratifiant » résume-t-elle. « Cela a construit ma carrière et m’a offert la liberté de suivre mes idées ».
Le parcours de Róisín Owens est à l’image de cette chercheuse polyglotte (parlant l’anglais, le gaélique, le français, l’allemand et le grec). Après des études de biochimie entre la France, l’Irlande et l’Angleterre, elle termine une thèse sur plusieurs protéines impliquées dans les maladies infectieuses, avant de s’envoler vers les États-Unis pour un premier post-doc à la Cornell University, s’intéressant alors à la tuberculose. En 2005, Róisín Owens quitte pour un temps la recherche fondamentale en intégrant une start-up new-yorkaise afin de développer des technologies pour améliorer la détection de pathogènes. « A l’époque, je voulais me diriger vers quelque chose de plus appliqué », explique-t-elle. Avant de se rendre compte, deux ans plus tard, que « [son] cœur était dans la recherche académique ». Elle retourne donc pour deux ans à la Cornell University dans un département d’ingénierie pour un nouveau post-doc. « Mon mari est grec, je suis irlandaise : au bout de huit ans aux États-Unis, nous voulions retourner en Europe » se souvient Róisín Owens. En 2009, ils intègrent alors tous deux Mines Saint-Etienne, où leur arrivée permet la création du département de Bioélectronique au Centre Microélectronique de Provence, qui compte aujourd’hui une trentaine de personnes.



















